PGC-1α مشتق شده از پپتید انرژی در فیبروبلاستهای پوستی طبیعی انسان را تحت تأثیر قرار می دهد
چکیده:
متابولیسم انرژی میتوکندری در طی پیری کاهش می یابد. PGC-1α یک عامل تعامل رونویسی است که نقش مهمی در تنظیم متابولیسم پرانرژی و بیوژنز میتوکندری در سلول ها دارد. هدف از این مطالعه مقایسه سطح بیان ژن PPARGC1A در فیبروبلاستهای پوستی طبیعی انسان (NHDF) ناشی از اهدا کنندگان جوان و پیر بود. سپس یک پپتید مشتق شده از PGC-1α سنتز شد و توانایی آن برای تأثیر در بیان ژن PPARGC1A و عملکرد میتوکندری مورد آزمایش قرار گرفت. ما با استفاده از RT-PCR کمی تغییرات در بیان ژن PPARGC1A را ارزیابی کردیم. تأثیر پپتید مشتق شده از PGC-1α بر تولید انرژی با استفاده از کیت سنجش سنجش بیولوژیکی ATP تعیین شد. ما همچنین تغییرات پتانسیل غشای میتوکندری را با استفاده از رنگهای فلورسنت JC-1 و سطح گونه های اکسیژن واکنش پذیر (ROS) با استفاده از رنگ DCFH-DA در سلولهای NHDF پس از تابش UVA / B مورد مطالعه قرار دادیم و به تنهایی و در ترکیب با تیمار پپتید قرار گرفتیم. بیان ژن PPARGC1A در یک فیبروبلاست پوستی در انسان سالخورده کاهش یافته است. پپتید مشتق شده PGC-1α سنتز شد و بیان ژن PPARGC1A و سطح ATP در سلول ها افزایش یافت. علاوه بر این ، پتانسیل غشای میتوکندری در سلولهای تابش شده با اشعه ماوراء بنفش UVA / B تحت درمان با پپتید مشتق شده از PGC-1α مشتق شده در مقایسه با گروه های تحت تابش افزایش یافته است. علاوه بر این ، سطح ROS در سلولهای تابش شده با اشعه UVA / B تحت درمان با پپتید مشتق از PGC-1α کاهش یافته است. بر اساس نتایج ما ، PGC-1α به عنوان یک هدف جالب برای مبارزه با کاهش سوخت و ساز انرژی در پیری سلول های پوستی ظاهر می شود. در واقع ، پپتید مشتق شده از PGC-1α با افزایش بیان ژن PPARGC1A باعث افزایش عملکرد میتوکندری و افزایش تولید انرژی در سلول ها می شود.
کلید واژه ها:
کشت سلولی؛ انرژی سلولی؛ پپتید؛ PGC-1α؛ پیری پوست
1. مقدمه
پیری پوست فرآیندی است که همراه با کاهش ظرفیت عملکردی سلولها و در نتیجه ایجاد اختلالات جسمی پوست است. در سطح درون سلولی ، دخالت میتوکندری در فرآیندهای پیری در مرکز توجه قرار دارد. در واقع ، تئوری میتوکندری پیر شدن هنوز یکی از گسترده ترین و به طور کلی پذیرفته ترین نظریه ها محسوب می شود [1]. میتوکندری تولید کنندگان اصلی انرژی سلولی به شکل ATP (آدنوزین تری فسفات) هستند. از طرف دیگر ، آنها همچنین سطح بالایی از گونه های اکسیژن فعال (ROS) تولید می کنند ، که توسط سیستم آنتی اکسیدانی خود از بین می روند. کاهش در تعداد یا عملکرد میتوکندری ، همراه با کاهش تولید ATP و افزایش تولید ROS به فرآیندهای پیری پوست کمک می کند [2،3].
تنظیم کننده های مهم بیوژنز میتوکندری و متابولیسم انرژی اعضای PGC-1 (پروکسیزوم گیرنده-γ فعال کننده پرولیفراتور γ) 1) خانواده از تعامل رونویسی هستند. این خانواده شامل Coactivators مربوط به PGC-1α ، PGC-1β و PGC است. PGC-1α تاکنون مشخص ترین بوده و ارتباط آن با پیری به دلیل ارتباط آن با عوامل مؤثر بر طول عمر ارگانیسم نشان داده شده است [4].
PGC-1α توسط ژن PPARGC1A رمزگذاری می شود. این پروتئین با طیف گسترده ای از فاکتورهای مختلف رونویسی و گیرنده های سلولی مؤثر بر فرآیندهای بیولوژیکی مختلف ، مانند ترموژنز تطبیقی ??، متابولیسم گلوکز و اسید چرب ، ساعت شبانه روزی ، آدیپوژنز ، بیوژنز پراکسیزوم و به ویژه بیوژنز میتوکندری و متابولیسم اکسیداتیو میتوکندری تعامل دارد. 5،6]. PGC-1α عوامل تنفسی هسته ای 1 و 2 (NRF1 و 2) را مهار می کند و بنابراین بیان فاکتور رونویسی میتوکندری A (mtTFA) و سایر زیر واحد های زنجیره حمل و نقل الکترونی را فعال می کند. mtTFA همچنین تکثیر DNA میتوکندری و بیان ژن را تحریک می کند. از این رو ، بیان زیاد PGC-1α باعث افزایش جرم میتوکندری می شود و عملکرد عملکرد را افزایش می دهد [7،8]. علاوه بر این ، PGC-1α سطح ROS در سلول ها را تحت تأثیر قرار می دهد. این بیان آنزیم های سم زدایی ROS و پروتئین های جدا نشده را تحریک می کند ، که پتانسیل الکتروشیمیایی را در غشای میتوکندری داخلی کاهش می دهد [9].
این پروتئین در بسیاری از انواع سلولی وجود دارد ، اما بیشتر در بافتهای غنی از میتوکندری با تقاضای انرژی زیاد مانند قلب ، مغز ، ماهیچه اسکلتی ، بافت چربی قهوه ای ، جزایر کبد و لوزالمعده بیان می شود [5،10]. در دوران پیری ، مسیرهای سیگنالینگ PGC-1α در برخی از بافت ها کاهش می یابد ، و این کاهش منجر به اختلال در عملکرد میتوکندری می شود. کاهش سطح PGC-1α باعث ایجاد اختلالات مختلف سلامتی در پیری ، مانند چاقی ، بیماری قلبی و دیابت می شود [4]. سرکوب رونویسی PGC-1α همچنین به پیشرفت بیماریهای عصبی کمک می کند [11،12]. علاوه بر این ، کاهش وابسته به سن در PGC-1α در بافت های مختلف مورد بررسی قرار گرفت. به عنوان مثال ، کاهش سطح PGC-1α در قلب موشهای مسن در مقایسه با موشهای جوان مشاهده شد [13]. علاوه بر این ، کاهش وابسته به سن بیان ژن PGC-1α و سطح پروتئین نیز در عضلات اسکلتی یافت شده است [14،15]. از سوی دیگر ، بیان بیش از حد ژن PPARGC1A در فیبروبلاست های جنینی موش 3T3 موش ، بیوژنز میتوکندری را تحریک می کند ، و به دنبال آن افزایش مقاومت در برابر استرس اکسیداتیو [16]. علاوه بر این ، بیان بیش از حد همولوگ Drosophila PGC-1 باعث افزایش فعالیت میتوکندری و افزایش طول عمر یک مگس شد [17]. PGC-1α در حین محدودیت کالری ، ورزش ، هیپوکسی و پس از درمان با داروهای خاصی مانند بزافیبات ، روزیگلیتازون ، AICAR ، متفورمین و رسوراترول فعال می شود [18،19،20،21]. بیان ژن PGC-1α در فیبروبلاستهای پوستی در انسان مربوط به سالخوردگی هنوز مورد مطالعه قرار نگرفته است.
هدف از این کار شناسایی ، آیا بیان تغییرات PGC-1α در فیبروبلاست های پوستی طبیعی انسان است که از اهدا کنندگان جوان و پیر استفاده می شود. پس از آن ، ما یک پپتید مشتق از PGC-1α را پیشنهاد و سنتز کردیم و تأثیر آن را بر بیان این پروتئین و بیوژنز و عملکرد میتوکندری ارزیابی کردیم.
2. مواد و روش ها
2.1. سنتز ، خالص سازی و شناسایی پپتید مشتق شده PGC-1α
پپتید مشتق شده از PGC-1α (TPPTTP) بطور دستی زیر پروتکلهای استاندارد Fmoc با استفاده از رزین کلرید 2-chlorotrityl ساخته شد (Iris Biotech ، Marktredwitz، آلمان). اسیدهای آمینه و مواد شیمیایی مورد استفاده در سنتز و جدا سازی از Iris Biotech (مارکتودویتز ، آلمان) بدست آمد. سایر حلالهای مورد استفاده برای شستشوی رزین از لاچنر (نرااتوویچ ، جمهوری چک) خریداری شد. اسیدهای آمینه از نظر آمینواسید اسید / HBTU / DIPEA با Fmoc محافظت شده (2/4/4) همراه بودند. پپتید مشتق شده PGC-1α از مخلوط حاوی TFA / DCM / anisole / thioanisole از رزین جدا شد (3/85/3). رزین با TFA شسته شد و پپتید با DEE رسوب کرد. پپتید خام دوباره در آب / پروپان-2-ol حل شد و با LC-MS 2020 (Shimadzu Europa ، Duisburg ، آلمان) خالص شد ، در Jupiter® 10u Proteo 90A ، 250 mm 21.2 mm 21MM (Phenomenex، Torrance، CA، USA) ) پپتید خالص (98?) لیوفیلیزه شد و ساختار آن با LC-MS 2020 (Shimadzu Europa ، Duisburg ، آلمان) ، بر روی Jupiter® 4u Proteo 90A ، 250 10 mm (Phenomenex، Torrance، CA، USA) تأیید شد. طیف نشانگر یون غالب در 613.5 m / Z [M] بود. یون های بیشتری در طیف MS در محدوده 250-800 متر بر Z وجود ندارد.
2.2. کشت سلولی ، پپتیدها و UVA / B تابش
فیبروبلاست های پوستی طبیعی انسان (NHDF) از پوست صورت که در حین جراحی زیبایی پلاستیک برداشته شده و به روش هضم جدا شده بود ، استخراج می شد [22]. کشت سلولی در Dulbecco"s Modified Eagle"s Medium (Sigma-Aldrich ، Saint Louis، MO ، USA) همراه با سرم 10? جنین گاو ، L-گلوتامین ، D- گلوکز ، پنی سیلین و استرپتومایسین در دمای 37 درجه سانتیگراد نگهداری شد. 5? CO2. مقادیر مناسب محلول سهام پپتید مشتق شده از PGC-1α حل شده در PBS برای دستیابی به غلظت نهایی 0.1-250 میکروگرم میلی لیتر-میلی لیتر -1 به محیط کشت اضافه شد. سلول ها اجازه داده شدند قبل از هر آزمایش 24 ساعت مستقر شوند.
2.3 زنده ماندن سلولها
برای ارزیابی اثر سمیت سلولی ترکیب مورد آزمایش بر زنده ماندن سلولی ، از معرف MTT (3- (4،5-دی متیل تیازول-2-ایل) -2-5-دیفنیل تترازولیوم برمید (سیگما-آلدریش ، سنت لوئیس ، مون ، ایالات متحده) استفاده شد. سلولهای 3T3 در ریزگردهای 96 چاه (103 5 5 سلول در چاه) بذر گذاشته شدند و اجازه داده شدند یک شبه در دمای 37 درجه سانتیگراد و در 5? CO2 مستقر شوند.در مرحله بعد ، کشت ها برای فواصل زمانی مختلف در معرض غلظت های مختلف پپتید قرار گرفتند. در پایان هر بازه ، روش MTT همانطور که قبلاً توضیح داده شد انجام شد [23].
2.4 تعیین بیان PPARGC1A ژن
طبق دستورالعمل سازنده سازنده ، RNA از سلولهای NHDF با استفاده از معرف RNAzol (مرکز تحقیقات مولکولی ، Inc. ، سینسیناتی ، OH ، آمریکا) جدا شد. سلولهای NHDF در ریزگردهای 6 چاه (103 300 300 سلول در چاه) کاشته شدند و اجازه داده شد یک شب در دمای 37 درجه سانتیگراد و 5? CO2 مستقر شوند. در مرحله بعد ، کشت ها در معرض غلظت های مختلف پپتید قرار گرفتند. RNA (1 میکروگرم) به روش معکوس به cDNA با استفاده از کیت رونویسی معکوس cDNA با ظرفیت بالا cDNA (کاربردهای بیوسیستم ، فاستر سیتی ، کالیفرنیا ، ایالات متحده) در سیستم RT-PCR Miniopticon (Bio-Rad ، Hercules ، CA ، USA) رونویسی شد. PCR در زمان واقعی کمی (qPCR) با استفاده از سنجش بیان ژن TaqMan (PPARGC1A: Hs01016719_m1 ؛ ژن نگهدارنده خانه: RPL13A: Hs03043885_g1) در شرایط دوچرخه سواری جهانی (15 دقیقه در 95 درجه سانتیگراد ، 40 چرخه 15 ثانیه در 95 درجه) انجام شد. C و 1 دقیقه با دمای 60 درجه سانتیگراد) در یک چرخه چرخنده PCR در زمان واقعی StepOne (Applied Biosystems، Foster City، CA، USA). چرخه آستانه (Ct) برای ژن های مورد علاقه تعیین شد و سطح نسبی mRNA در هر نمونه با استفاده از روش 2-ΔΔCt محاسبه شد.
2.5. ATP Assay
محتوای ATP در سلولهای NHDF با توجه به دستورالعمل سازنده توسط کیت سنجش CellTiter-Glo® Luminescent (شرکت Promega ، مدیسون ، WI ، آمریکا) تعیین شد.
2.6. اندازه گیری پتانسیل غشای میتوکندری
پتانسیل غشای میتوکندری در سلولهای NHDF (صفحه چاه 96 ، سلولهای 103 5 5 چاه / چاه ، اجازه داده شد برای 24 ساعت حل و فصل) با UVA / B تحت تابش قرار گرفته و با پپتید مشتق شده از PGC-1α تحت درمان قرار گرفت. برای تیمار با اشعه ماوراء بنفش اشعه ماوراء بنفش ، سلولها در صفحات کشت با استفاده از یک شبیه ساز UV-خورشیدی 1000 W زنون زنون تابانده شدند (اوریل ابزار ، نیوپورت ، نیویورک ، ایالات متحده). رنگ JC-1 (سیگما-آلدریچ ، سنت لوئیس ، MO ، ایالات متحده) برای رسیدن به غلظت نهایی 5 میکرومولار به سلولهای NHDF اضافه شد. بعد از 20 دقیقه جوجه کشی ، سلول ها با PBS شسته شدند و فلورسانس قرمز توسط EnSightTM Multimode Plate Reader (PerkinElmer ، Waltham ، MA ، USA) اندازه گیری شد [24].
2.7 ROS سنجش
برای اندازه گیری میزان تولید ROS در سلولهای NHDF (صفحه 96 چاه ، سلولهای 103 5 5 چاه / چاه ، مجاز به استقرار 24 ساعت) با UVA / B تحت تابش قرار گرفته و با ترکیب آزمایش شده تحت درمان قرار گرفتیم ، از DCFH-DA استفاده کردیم (2 ′ -7′-دی کلرو دی هیدروفلورسئین دیاستات ؛ سیگما-آلدریچ ، سنت لوئیس ، MO ، ایالات متحده آمریکا) روش. برای تیمار با اشعه ماوراء بنفش اشعه ماوراء بنفش ، سلولها در صفحات کشت با استفاده از یک شبیه ساز UV-خورشیدی 1000 W زنون زنون تابانده شدند (اوریل ابزار ، نیوپورت ، نیویورک ، ایالات متحده). DCFH-DA پیشرو غیر فلورسنت با نفوذپذیری غشایی است که توسط استرهای سلولی بریده می شود و در حضور ROS به فلورسنت DCF (2 ′ ، 7′-دیکلرولوفلورسئین) تبدیل می شود [25]. در پایان درمان ، سلولهای NHDF با DCFH-DA (15 میکرومولار به مدت 30 دقیقه) انکوبه شدند و فلورسانس با استفاده از یک صفحه خواننده چند صفحه EnSightTM (PerkinElmer ، Waltham ، MA ، USA) در λex 485 نانومتر و لیم 530 نانومتر اندازه گیری شد.
2.8 تحلیل آماری
داده ها به معنای SEM حداقل سه آزمایش مستقل بیان شده و تجزیه و تحلیل آماری با استفاده از آزمون t دانشجویی انجام شده است.
3. نتایج
3.1 بیان ژن PPARGC1A در NHDF از اهدا کنندگان جوان و پیر
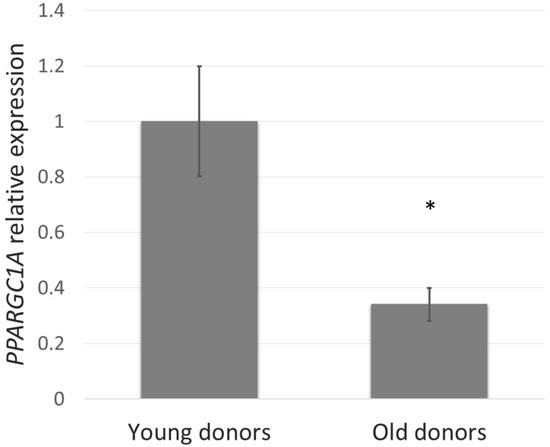
اول ، ما بررسی کردیم که آیا سطح PGC-1α به سن بستگی دارد و بنابراین می تواند در روند پیری پوست نقش داشته باشد. برای ارزیابی این ، بیان ژن PPARGC1A در سلولهای NHDF از افراد جوان (5-9 ساله) در مقایسه با اهدا کنندگان قدیمی (44-60 سال) تعیین شد. در فیبروبلاستهای بدست آمده از اهدا کنندگان قدیمی ، بیان PPARGC1A بیش از 60? کاهش یافته است (شکل 1).
شکل 1. بیان ژن PPARGC1A در سلولهای فیبروبلاست پوستی طبیعی انسان (NHDF) از اهداکنندگان جوان (5-9 ساله) و قدیمی (44-60 سال) توسط RT-PCR کمی تعیین شد. مقادیر نشان دهنده means SEM سلولهای NHDF از 5 اهداکننده برای هر گروه است (* p <0.05 در مقایسه با اهدا کنندگان جوان).
3.2 پیشنهاد و سنتز پپتید مشتق شده از PGC-1α
از آنجا که کاهش وابسته به سن در بیان ژن PPARGC1A را ثابت کردیم ، هدف بعدی ما پیشنهاد و سنتز پپتیدهایی است که می توانند بر این بیان ژن تأثیر بگذارند و بنابراین متابولیسم انرژی را در سلولهای NHDF افزایش دهند. ما چندین پپتید (قطعه پروتئین PGC-1α) را پیشنهاد کردیم و تأثیر آنها را در بیان ژن PPARGC1A (داده ها نشان داده نشده است) مطالعه کردیم. یک پپتید برای افزایش فعالیت PPARGC1A نشان داده شد و برای مطالعات بیشتر انتخاب شد (داده ها نشان داده نشده است). این روش قبلاً برای القاء بیان ژن جزء خارج سلولی استفاده شده بود. القای تولید کلاژن نوع I در سلولهای تحت درمان با زیرمجموعه ای از کلاژن پروپتید نوع I نشان داده شد [26،27] و تنظیم بازخورد منفی یا مثبت تولید ماتریس خارج سلولی پیشنهاد شد. به بهترین دانش ما ، القای اجزای درون سلولی با استفاده از زیرشاخه آنها هنوز مورد مطالعه قرار نگرفته است.
3.3 زنده ماندن سلولها
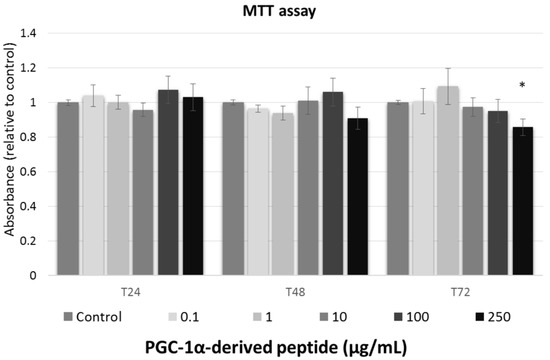
ما اثر پپتید تست شده در غلظتهای مختلف (0 ، 0.1 ، 1 ، 10 ، 100 و 250 میکروگرم بر میلی لیتر) بر زنده ماندن سلول فیبروبلاست موش 3T3 موش در زمانهای مختلف مواجهه (24 ، 48 و 72 ساعت) مطالعه کردیم. برای ارزیابی زنده ماندن سلول پس از تیمار با ترکیبات آزمایش شده ، از آزمون MTT استفاده شد.
در برابر ISO 10993-5 [28] ، این مواد به عنوان غیر سمی در نظر گرفته می شوند ، هنگامی که زنده ماندن سلول بالای 80? ، سمی ضعیف (زنده ماندن سلول 60-80?) ، سمی متوسط ??(40-60?) و سمی قوی باشد. (به ترتیب زیر 40?) همانطور که در شکل 2 نشان داده شده است ، پپتید آزمایش شده هیچ اثر سیتوکسیک در فیبروبلاست های موش ندارد و بنابراین ، می تواند برای استفاده ضد پیری در نظر گرفته شود.
شکل 2. زنده ماندن سلولهای فیبروبلاست ماوس 3T3 سوئیسی. سلولهای کشت شده با پپتید مشتق شده از PGC-1α در غلظتهای مختلف به مدت 24 ، 48 و 72 ساعت تحت درمان قرار گرفتند و سپس با استفاده از آزمون MTT مورد بررسی قرار گرفت. مقادیر نشان دهنده means SEM حداقل 3 آزمایش مستقل است (* p <0.05 در مقایسه با گروه کنترل نشده).
3.4 تأثیر پپتید مشتق شده PGC-1α بر بیان ژن PPARGC1A
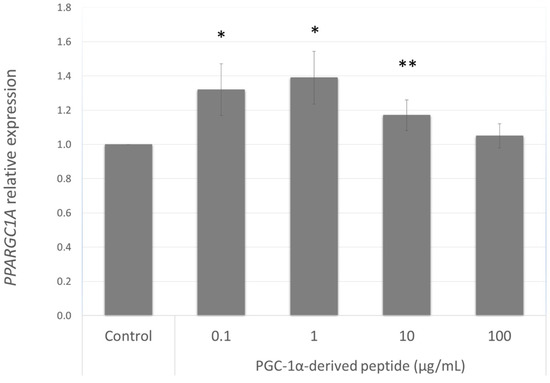
هدف ما یافتن پپتیدی بود که بتواند بیان ژن PPARGC1A را در سلولهای NHDF از اهدا کنندگان قدیمی افزایش دهد. از این رو ، ما بیشتر اثر پپتید مشتق شده از PGC-1α را در غلظت های مختلف (0.1 ، 1 ، 10 و 100 میکروگرم میلی لیتر در میلی لیتر) پس از 24 ساعت درمان بر بیان ژن PPARGC1A بررسی کردیم. همانطور که در شکل 3 مشاهده می شود ، پپتید مشتق شده از PGC-1α باعث افزایش معنی داری در بیان ژن PPARGC1A در غلظت های 0.1 ، 1 و 100 میکروگرم میلی لیتر میلی لیتر -1 شد.
شکل 3. بیان ژن PPARGC1A در سلولهای NHDF. سلولهای NHDF با پپتید مشتق شده از PGC-1α در غلظتهای مختلف به مدت 24 ساعت تحت درمان قرار گرفتند ، سپس بیان ژن PPARGC1A با استفاده از RT-PCR کمی تعیین شد. مقادیر نشان دهنده means SEM حداقل 3 آزمایش مستقل است (* p <0.05 ، ** p <0.01 در مقایسه با گروه کنترل نشده).
3.5. اندازه گیری سطح ATP
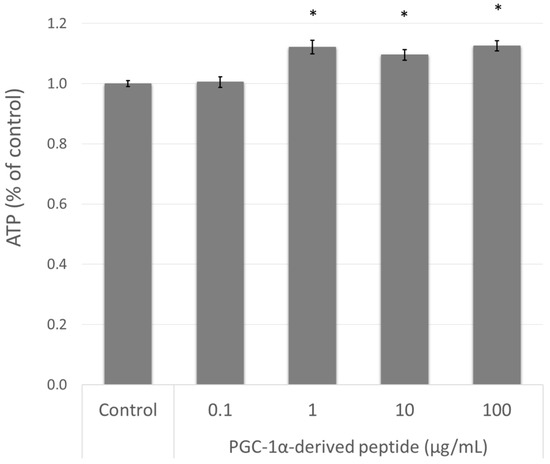
افزایش بیان ژن PPARGC1A به بیوژنز میتوکندری و بنابراین با سطح ATP داخل سلولی مرتبط است [10]. بنابراین ، ما سلولهای NHDF را با پپتید مشتق شده از PGC-1α درمان کردیم و پس از 24 ساعت سطح ATP را با استفاده از روش زیست سنجشایی که در بالا توضیح داده شد اندازه گیری کردیم. همانطور که در شکل 4 مشاهده می شود ، پپتید مشتق شده از PGC-1α در غلظت 1 ، 10 و 100 میکروگرم میلی لیتر-میلی لیتر 1 به طور قابل توجهی محتوای ATP داخل سلولی را بعد از جوجه کشی 24 ساعته افزایش داد.
شکل 4. سطح ATP (آدنوزین تری فسفات) در سلولهای NHDF. سلولهای NHDF با پپتید مشتق شده از PGC-1α در غلظتهای مختلف به مدت 24 ساعت تحت درمان قرار گرفتند ، سپس ATP اندازه گیری شد. مقادیر نشان دهنده means SEM حداقل 3 آزمایش مستقل است (* p <0.05 در مقایسه با گروه کنترل نشده).
3.6. ارزیابی پتانسیل غشای میتوکندری
پتانسیل غشای میتوکندری یک پارامتر مهم در ارزیابی عملکرد میتوکندری است. تابش اشعه ماوراء بنفش باعث کاهش پتانسیل غشای میتوکندری می شود [29]. از این رو سلول های NHDF را با UVA / B تحت تابش قرار دادیم و سپس آنها را با پپتید مشتق شده از PGC-1α درمان کردیم. بعد از 24 ساعت جوجه کشی ، تغییرات در پتانسیل غشای میتوکندری با استفاده از رنگ JC-1 اندازه گیری شد. رنگ JC-1 دانه های فلورسنت J نارنجی را در سلولهای کنترل تشکیل می دهد و دپلاریزاسیون غشای میتوکندری منجر به تولید مونومرهای فلورسانس سبز JC-1 می شود. تغییر در فلورسانس قرمز و سبز در سلولهای تحت درمان با استفاده از میکروسکوپ فلورسنت مشاهده شد. فلورسانس قرمز در سطح بالایی در سلولهای شاهد با پتانسیل غشای میتوکندری بدون تغییر وجود داشت. از طرف دیگر ، فلورسانس سبز در سلولهایی با پتانسیل غشای میتوکندری مختل شده افزایش یافته است (شکل 5A). پپتید مشتق شده از PGC-1α در غلظت 1 ، 10 و 100 میکروگرم میلی لیتر-میلی لیتر 1 به طور قابل توجهی پتانسیل غشای میتوکندری را در سلولهای تابش شده UVA / B بالا برد (شکل 5B).
شکل 5. پتانسیل غشای میتوکندری در سلولهای NHDF. سلولهای کشت شده با UVA / B با دوز 0.15 J / cm2 تحت تابش قرار گرفتند و سپس با پپتید مشتق شده از PGC-1α در غلظتهای مختلف به مدت 24 ساعت تحت درمان قرار گرفتند. پتانسیل غشای میتوکندری با استفاده از رنگ JC-1 با میکروسکوپ فلورسانس (A) و یک دستگاه فلورسانس فلورسانس (B) تعیین شد. مقادیر نشان دهنده means SEM حداقل 3 آزمایش مستقل است (* p <0.05 در مقایسه با گروه تحت اشعه ماوراء بنفش).
3.7 ارزیابی سطح ROS
PGC-1α همچنین در سم زدایی ROS در سلول ها نقش دارد. بنابراین ، ما سطح ROS را در سلولهای NHDF تابش شده با اشعه ماوراء بنفش (UVA / B) (دوز 0.15 J-cm-2) تحت درمان با پپتید مشتق از PGC-1α در غلظت های مختلف ارزیابی کردیم. نتایج ما کاهش معنی داری در سطح ROS در سلولهای تابش شده با اشعه ماوراء بنفش اشعه ماوراء بنفش تحت درمان با پپتید مشتق شده از PGC-1α در غلظت 1 ، 10 و 100 میکروگرم میلی لیتر در دقیقه پس از جوجه کشی 1 ساعته نشان می دهد (شکل 6A). مقدار بیشتری از ROS نیز در سلولهای تابش شده UVA / B تحت میکروسکوپ فلورسانس با کاهش سطح ROS در سلولهای تحت درمان با پپتید مشتق شده از PGC-1α مشاهده شد (شکل 6B).
شکل 6. سطح اکسیژن واکنش پذیر (ROS) در سلول های NHDF. سلولهای کشت شده با UVA / B با دوز 0.15 J / cm2 تحت تابش قرار گرفتند و سپس با پپتید مشتق شده از PGC-1α در غلظتهای مختلف به مدت 1 ساعت تحت درمان قرار گرفتند. سطح ROS با استفاده از رنگ DCFH-DA با میکروسکوپ فلورسنت (A) و یک دستگاه خواننده فلورسانس (B) تعیین شد. مقادیر نشان دهنده means SEM حداقل 3 آزمایش مستقل است (* p <0.05 ، ** p <0.01 در مقایسه با گروه تحت تابش اشعه ماوراء بنفش).
3.8 اثر پپتید مشتق شده PGC-1α بر بیان ژن پایین دست PGC-1α
بیان زیاد PPARGC1A باعث افزایش پتانسیل غشای میتوکندری و کاهش سطح ROS در سلولهای تحت درمان با UVA / B می شود. این پیشرفت می تواند ناشی از تنظیم برخی ژن های خاص در این فرایندها باشد. بنابراین ، بیان ژن MFN2 و UCP2 (شکل 7) را در سلولهای تحت درمان با پپتید مشتق شده از PGC-1α ارزیابی کردیم. بیان بالای این ژنها با بیان زیاد PPARGC1A ارتباط دارد.
شکل 7. بیان ژن MFN2 و UCP2 در سلولهای NHDF. سلولهای NHDF با پپتید مشتق شده از PGC-1α در غلظتهای مختلف به مدت 24 ساعت تحت درمان قرار گرفتند ، سپس بیان ژنها توسط RT-PCR کمی تعیین شد. مقادیر نشان دهنده means SEM حداقل 3 آزمایش مستقل است (* p <0.05 ، ** p <0.01 ، *** p <0.001 در مقایسه با گروه کنترل نشده).
4. بحث
در طول پیری پوست ، از نظر تعداد و عملکرد ، میتوکندری کاهش می یابد. دلیل اصلی این کاهش این است که میتوکندری ها به واسطه ROS آسیب می بینند و این آسیب باعث ایجاد پروتئین و جهش DNA میتوکندری می شود که منجر به کاهش بیوژنز میتوکندری ، فسفوریلاسیون اکسیداتیو و کاهش تولید ATP می شود. از آنجا که میتوکندری ها در متابولیسم انرژی نقش اصلی دارند ، ترکیبات تحریک کننده بیوژنز میتوکندری می توانند مزایای بسیاری برای پیری پوست ایجاد کنند ، مانند دفاع اکسیداتیو ، بقای سلولی ، بهبود مانع پوست و محافظت در برابر آلودگی [30،31].
بیوژنز میتوکندری فرایندی است که به طور عمده توسط PGC-1α کنترل می شود [8]. با این حال ، تأثیر بیان PGC-1α در پوست سالخورده هنوز مورد مطالعه قرار نگرفته است. کاهش بیان ژن PPARGC1A در سلولهای فیبروبلاست پوستی طبیعی انسان از اهدا کنندگان قدیمی نسبت به اهدا کنندگان جوان کاهش یافته است. این می تواند به کاهش تعداد میتوکندری و عملکرد مشاهده شده در سلولهای مسن پوست کمک کند.
در این کار ، ما سعی کردیم بیان ژن PPARGC1A را با یک پپتید مشتق از PGC-1α افزایش دهیم. ما پیشنهاد کردیم که یک قطعه پروتئین PGC-1α می تواند بیان ژن این پروتئین را تحریک کند. در واقع ، پپتید مشتق شده از PGC-1α بیان ژن PPARGC1A را در غلظت های آزمایش شده افزایش داد.
افزایش سطح PGC-1α فواید خاصی دارد ، از جمله افزایش توده میتوکندری و تولید ATP در سلول. ارتفاع بیوژنز میتوکندری احتمالاً در اثر بالا رفتن NRF ها ایجاد می شود ، که توسط PGC-1α تنظیم شده و بیان ژن های متعدد میتوکندری را تحریک می کند. افزایش بیوژنز میتوکندری منجر به افزایش تولید ATP می شود [2]. بنابراین ، ما اثر پپتید مشتق از PGC-1α بر تولید ATP را ارزیابی کردیم. پپتید مشتق از PGC-1α باعث ارتفاع قابل توجهی از تولید ATP در سلولهای NHDF شد. علاوه بر این ، اثر پپتید مشتق شده PGC-1α بر عملکرد میتوکندری در سلول ها پس از درمان UVA / B مورد آزمایش قرار گرفت. پپتید مشتق از PGC-1α پتانسیل غشای میتوکندری در سلولهای NHDF تحت درمان با UVA / B را افزایش داد. قبلاً توسط دنینگ و همکاران ارزیابی شده بود. تابش اشعه ماوراء بنفش باعث کاهش پتانسیل غشای میتوکندری در کراتینوسیتهای انسانی شد [29]. PGC-1α همچنین بر بیان آنزیم های سم زدایی ROS و پروتئین های جدا نشده (UCP) تأثیر می گذارد و بنابراین باعث کاهش سطح ROS در سلول ها می شود [32]. پپتید مشتق از PGC-1α همچنین باعث کاهش سطح ROS در سلولهای NHDF تحت درمان با تابش UVA / B شد و بیان UCP2 را افزایش داد. ما همچنین ارتفاع ژن MFN2 را که میتوفوزین را رمزگذاری می کند ثابت کرد. میتوفوزین در حفظ مورفولوژی میتوکندری نقش دارد و پتانسیل غشای میتوکندری را تقویت می کند [33]. سطح ژنهای UCP2 و MFN2 با بیان ژن PPARGC1A ارتباط دارد. با این حال ، تفاوت بین بیان ژن PPARGC1A و تأثیر تولید ATP ، پتانسیل غشای میتوکندری و سطح ROS در سلولهای تحت درمان با 100 میکروگرم در میلی لیتر PGC-1α مشتق شده از پپتید وجود دارد. سطح پروتئین PGC-1α می تواند نتایج بهتری را به همراه آورد ، اما ما تأثیر شواهد غیرمستقیم (پتانسیل غشای میتوکندری ، ATP ، ROS) را نشان دادیم. از آنجا که PGC-1α بر این فرآیندهای سلولی تأثیر می گذارد ، می توانیم تأثیر سطح PGC-1α را در سلولها نیز پیش بینی کنیم.
در نتیجه ، بیان ژن PPARGC1A در فیبروبلاستهای سالخورده کاهش یافته است - این احتمالاً به کاهش میزان متابولیسم و کاهش میتوکندری از نظر تعداد و عملکرد اغلب در پوست سالخورده منجر می شود. پپتید مشتق از PGC-1α باعث افزایش بیان ژن PPARGC1A در سلولهای NHDF شد. علاوه بر این ، بر تولید ATP و پتانسیل غشای میتوکندری در سلولهای NHDF نیز تأثیر گذاشت. ارتفاع PGC-1α همچنین باعث کاهش سطح ROS شد. این نتایج نشان می دهد که افزایش سطح PGC-1α می تواند از تناسب اندام پوست سود ببرد ، و اثر پپتید مشتق شده از PGC-1α به عنوان کاندیدای بررسی بیشتر در مطالعات داخل بدن برای تأیید چنین فرضیاتی ظاهر می شود.
تشکرها
نویسندگان از مارتینا تپلی بخاطر کمکهای فنی تشکر می کنند.
مشارکتهای نویسنده
این آزمایشات را Lenka Suchá و Iva Dole?kovived انجام دادند ، Lenka Soáá Len ، آزمایش Romana Šuláková از پپتید ، تصفیه رومی Fry?ák و شناسایی پپتید را انجام دادند.